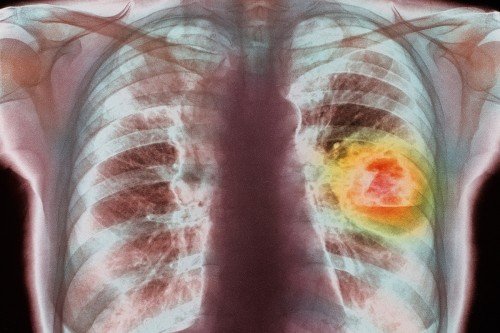
这张图片显示了 KRAS 突变的肺癌细胞。资料来源:美国国立卫生研究院
对于癌症生物学家而言,他们一直致力于找到一种能靶向 KRAS 蛋白的药物。
KRAS 是癌症中最常见的突变蛋白之一,但直到最近人们还认为它基本上是不可药物治疗的——近乎球形的结构使其成为一个非常光滑的靶点。但在过去的几年中,科学家已发现用于阻止一种特定 KRAS 突变(KRAS G12C)的方法。蛋白质在“启动”和“关闭”之间循环,产生细微的形状变化,使得被称为 KRAS G12C 抑制剂的药物能够与之结合并使其失效。这些药物目前正处于 I 期临床试验阶段,其已显示出能够为肺癌患者带来极大希望的潜力,但它们只能为患者带来部分获益:肿瘤并不能完全缩小,且仅在一部分患者中能够缩小肿瘤。
纪念斯隆凯特琳癌症中心的科学家们于 1 月 8 日在 《自然》(Nature) 杂志上在线发表了一项新的研究,研究已确定了这种反应模式的一种机制,并提出了可以规避这种机制的方式。
据论文的通讯作者、人类肿瘤和发病机制计划的医师科学家 Piro Lito 介绍,用这些抑制剂处理培养皿中生长的癌细胞会导致细胞产生新的 KRAS G12C 蛋白。一些新合成的蛋白质呈现出对药物不敏感的形状,从而使种群中的一些细胞逃脱了药物的作用。相比之下,新蛋白仍处于药物敏感状态的细胞则继续受到治疗的抑制。
Lito 博士和他的同事们发现,可通过添加第二种药物,帮助保持新的 KRAS G12C 蛋白处于可靶向用药的状态,从而使这种适应性反应达到最小化。这类组合用药的临床试验将于 2020 年初开始进行。
在最短的时间内将实验室发现转化为临床成果
MSK 斯隆在 KRAS G12C 抑制剂的临床前和早期临床开发中都发挥了关键作用。在 2016 年发表于 《科学》(Science) 杂志上的一篇论文中,Lito 博士和他的同事们描述了 KRAS G12C 抑制剂使突变蛋白失活的作用机制。随后,这一发现转化产生临床成果仅经历了很短的时间。
“这些药物只会靶向作用于突变型 KRAS G12C,而不会作用于野生型 KRAS”, Lito 实验室博士后、本篇新论文的共同第一作者 Yulei Zhao 讲道,“因此,它们的毒性可能很小。”
这项研究的新发现在一定程度上是通过一种叫做单细胞 RNA 测序的技术实现的,该技术使得研究人员能够同时测量成千上万个单个细胞的药物反应。根据这些数据,他们能够确定一些细胞仍然受到药物的抑制,而另一些细胞则迅速适应了治疗;这对确定适应机制至关重要。
“如果我们使用批量分析方法,我们只能看到整个人群的平均治疗效果,“ Lito 实验室的 Tri-I MD/PhD 学生、论文的另一位第一作者 Jenny Xue 讲道,“这种适应过程在单个细胞水平上的复杂性就会被掩盖。”
直接临床意义
多项 KRAS G12C 抑制剂的试验正在 MSK 斯隆进行患者招募。这些试验由胸肿瘤科服务部门的 Gregory Riely和早期药物开发服务部门的 Bob Li 与 Lito 博士共同合作开展。
Lito 博士表示,“我们的研究可以帮助我们更好地了解癌细胞如何适应和耐受治疗,并发现可以改善患者结局的联合疗法。”